Científico: Incidencia de Nosema ceranae durante el invierno en colonias de abejas melíferas retiradas de una forestación de Eucalyptus grandis
Veterinaria (Montevideo) 48 (188) 13-19 (2012)
Autores: Mendoza, Y. *; Díaz, S.1; Ramallo, G1; Invernizzi, C.
Recibido: 25/5/12
Aceptado: 9/8/12
Resumen
La nosemosis es una enfermedad del sistema digestivo de las abejas melíferas (Apis mellifera) causada por los microsporidios Nosema apis y Nosema ceranae. En Uruguay solo ha sido detectado N. ceranae. La enfermedad se presenta indefectiblemente en las colonias que se trasladan a las forestaciones de Eucalyptus grandis al final del verano y suele causar importantes pérdidas cuando las colonias permanecen allí durante el invierno. Los objetivos de este estudio fueron determinar cómo N. ceranae afecta la invernada de las colonias que se retiran de las plantaciones de E. grandis en otoño, y si la suplementación proteica afecta el nivel de infección. En mayo se instalaron dos apiarios en Salto y San José con colonias retiradas de una plantación de E. grandis. Las colonias recibieron uno de los siguientes tratamientos: 1) control de nosemosis, 2) suplementación proteica, 3) control de nosemosis y suplementación proteica, y 4) sin control de nosemosis y sin suplementación proteica (testigo). En primavera se encontró en ambos apiarios que las colonias de los diferentes grupos no diferían en población y área de cría. En el apiario de San José no se encontró diferencia en el nivel de nosemosis entre las colonias con diferentes tratamientos, pero en el de Salto las colonias que no recibieron fumagilina y con suplementación proteica estaban más infectadas que las colonias tratadas con antibiótico y sin suplementación proteica. Este estudio muestra que N. ceranae no afecta a las colonias durante la invernada y que la suplementación proteica puede aumentar la infección.
PALABRAS CLAVE: Apis mellifera, Nosemosis, parásitos, invernada
1. Introducción
La nosemosis es una enfermedad que afecta las funciones digestivas de las abejas melíferas (Apis mellifera) causada por los microsporidios Nosema apis y Nosema ceranae (Fries, 2010). Durante más de un siglo se creyó que N. apis era la única especie responsable de la nosemosis. Sin embargo, en el año 2005 Higes y col. (2006) encontraron que N. ceranae, cuyo hospedero original es la abeja asiática Apis cerana (Fries y col., 1996), estaba presente en España infectando a A. mellifera. Actualmente, N. ceranae se halla ampliamente distribuido en el mundo (Klee y col., 2007; Fries, 2010; Aurori y col., 2011). En Uruguay Invernizzi y col. (2009) encontraron únicamente a N. ceranae en todas las regiones del país y confirmaron la presencia de esta especie en una muestra de abejas colectada antes de 1990.
La presencia de N. ceranae, aparentemente más virulento que N. apis (Higes y col., 2007; Martín-Hernández y col., 2007; Paxton y col., 2007; Higes y col., 2008; Higes y col., 2010), podría ser una de las causas de las elevadas pérdidas de colonias ocurridas en los últimos años en Europa y Estados Unidos (Stokstad, 2007; van Engelsdorp y col., 2009; Neumann y Carreck, 2010; Potts y col., 2010). Sin embargo, varios estudios han puesto en duda la responsabilidad de N. ceranae en las pérdidas de colonias (Cox-Foster y col., 2007; Chen y col., 2008; Gómez Pajuelo y col., 2008; Invernizzi y col., 2009; Forsgren y Fries, 2010; Williams y col., 2011; Traver y col., 2012).
En Uruguay la nosemosis se presenta indefectiblemente en las colonias que se trasladan a las plantaciones comerciales de Eucalyptus grandis durante el periodo de floración entre los meses de febrero y mayo (Invernizzi y col., 2011a; Invernizzi y col., 2011b). Los apicultores suelen reportar importantes pérdidas de colmenas cuando los apiarios no pueden ser retirados al finalizar la floración y permanecen en las plantaciones durante el invierno. Invernizzi y col. (2011b) corroboraron esta situación encontrando que colonias libres de nosemosis trasladadas a una forestación de E. grandis al comienzo de la floración presentaban al finalizar la misma un promedio de pecoreadoras infectadas de 90,8% y dos meses después constataron la pérdida del 39% de las colonias y un extremo debilitamiento de las restantes. Los autores adjudican a la nosemosis la elevada mortandad de colonias registrada. También Mendoza y col. (2012) encontraron en una forestación de E. grandis que la infección por N. ceranae incide en la mortandad y tamaño de las colonias durante el invierno.
Según Fries (1995) la deficiencia de proteína es una de las causas que incrementa la nosemosis, especialmente cuando las abejas aprovechan flujos de néctar en otoño e invierno. En el estudio de Invernizzi y col. (2011b), realizado en una forestación de E. grandis se constató, durante la primera mitad del periodo de floración, que las colonias que disponían de reservas de polen de variado origen botánico presentaban menor nivel de infectación por N. ceranae que las colonias que solo disponían del polen de los eucaliptos. Sin embargo, Rinderer y Dell Elliott (1977) y Porrini y col. (2011), trabajando en condiciones de laboratorio con abejas confinadas en cajas hallaron que las abejas infectadas con Nosema spp. y alimentadas con polen se infectaban más que las abejas que no disponían de polen.
Los objetivos de este estudio fueron determinar cómo N. ceranae afecta la invernada de colonias fuertemente infectadas retiradas de una plantación de E. grandis, y si la suplementación proteica afecta el nivel de infectación de las abejas.
Materiales y Métodos
Dos apiarios de 114 y 76 colonias que entre marzo y mayo del año 2010 permanecieron en una forestación de E. grandis en el departamento de Rivera durante el periodo de floración, fueron trasladados a fines de mayo a Salto y San José, respectivamente. Antes de retirar los apiarios las colonias recibieron un tratamiento acaricida para eliminar al ácaro Varroa destructor. Los lugares donde se emplazaron los apiarios son áreas abiertas con pequeños aportes de néctar y polen provenientes de diversas fuentes florales. Estos sitios son similares a los que los apicultores utilizan en gran parte del país para emplazar los apiarios.
Una vez instalados los apiarios, el 16 de junio en San José y el 23 de junio en Salto, se registró el nivel de infección por N. ceranae, la población de abejas, el área de cría, y las reservas de miel y polen de las colonias. Para medir la infección se colectaron abejas pecoreadoras cuando regresaban a la colmena (tapando la piquera) y luego se maceraron conjuntamente los abdómenes de 60 abejas determinando el número promedio de esporas por abeja con un hemocitómetro (Cantwell 1970). La población de abejas se midió como el número de panales cubiertos por abejas, mientras que el área de cría se estimó como cuartos de cara de panal ocupados por huevos, larvas o pupas. La reserva de polen se evaluó como cuartos de cara de panal conteniendo polen ensilado y la de miel contando el número de panales con miel. Todas las estimaciones se realizaron visualmente por el mismo observador.
En cada apiario se formaron cuatro grupos homogéneos de colonias en cuanto a población, área de cría y reservas de alimento y se aplicaron los siguientes tratamientos: 1) control de la nosemosis, 2) suplementación proteica, 3) control de la nosemosis y suplementación proteica, y 4) sin control de la nosemosis y sin suplementación proteica (testigo). En el apiario de Salto el número de colonias asignado a cada uno de los tratamientos fue de 30, 30, 28 y 26, respectivamente, mientras que en el apiario de San José se asignaron 19 colonias a cada tratamiento.
Para controlar la nosemosis se suministró a cada colonia 200 mg de fumagilina mezclados en 200 g de candi (mezcla de azúcar impalpable y fructosa) en una sola aplicación (Gómez Pajuelo y col. 2008). El producto comercial utilizado fue Nosemix del laboratorio Kinter. Los tratamientos fueron realizados el 29 de junio en el apiario San José y el 10 de julio en el de Salto.
La suplementación proteica de las colonias se hizo con dos tortas de 150 g compuestas por 50% de levadura de cerveza, 30% de azúcar impalpable, 16,5% de fructosa y 3,5% de aceite de girasol, siendo éstos los productos y las proporciones más utilizadas por los apicultores para aportar proteínas a las colonias (Herbert, 1992). La primera torta de suplemento proteico fue suministrada conjuntamente con la aplicación de fumagilina y la segunda 20 días después.
La infección por N. ceranae, la población de abejas y el área de cría de las colonias fue determinada el 27 de setiembre en el apiario de Salto y el 5 de octubre en el apiario de San José.
La población de abejas, el área de cría y el nivel de nosemosis de las colonias de los diferentes grupos en el mes de junio se compararon utilizando la prueba no paramétrica de Kruskal-Wallis debido a que los datos no cumplían con los supuestos de la estadística paramétrica. En primavera el nivel de nosemosis de las colonias con diferentes tratamientos se comparó utilizando un análisis de varianzas (ANOVA) luego de una transformación logarítmica de los datos. Posteriormente se empleó el test de Tukey para comparar las medias de los diferentes grupos. En todos los casos se estableció un nivel de significación de 0,05. Los cálculos se realizaron empleando el programa estadístico R (R Development Core Team 2010).
Resultados
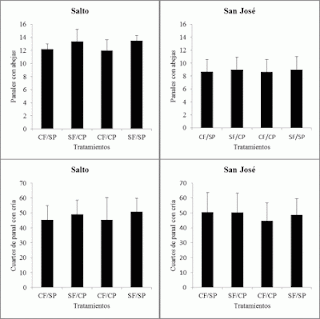
Todas las colonias retiradas de la forestación de E. grandis y llevadas a Salto y San José estaban infectadas con N. ceranae, salvo tres colonias del apiario de San José en las que no se encontraron esporas (Salto: 0,9 ± 0,6 millones esporas por abeja, San José: 1,4 ± 0,9 millones esporas por abeja). En la Figura 1 se muestra la distribución de colmenas en los apiarios de Salto y San José según los millones de esporas por abeja encontrados. El nivel de nosemosis, la población adulta, el área de cría y las reservas de miel y polen de ambos apiarios se muestran en el Cuadro 1.
Cuadro 1
Población: panales cubiertos por abejas.
Cría: cuartos de cara de panal.
Polen: cuartos de cara de panal.
Miel: número de panales con miel.
Tanto en el apiario de Salto como en el de San José, previo a la aplicación de los tratamientos no hubieron diferencias estadísticas entre los cuatro grupos de colonias en el nivel de infección por N. ceranae (Salto: Chi2 = 4,613; P = 0,20; San José: Chi2 = 5,053; P = 0,17), la población de abejas (Salto: Chi2 = 0,888; P = 0,83; San José: Chi2 = 0,692; P = 0,88) y el área de cría (Salto: Chi2 = 1,821; P = 0,61; San José: Chi2 = 3,059; P = 0,38).
A lo largo del invierno se constató la pérdida de tres colonias en el apiario de Salto (2,6%) y 7 en el de San José (9,2%). De las 10 colonias muertas, cinco habían recibido fumagilina y suplementación proteica, dos habían recibido fumagilina, una había recibido suplementación proteica y dos correspondían al grupo control. Aunque el espaciamiento de las visitas a los apiarios no permitió visualizar las causas de la muerte de las colonias, se supone la pérdida de reinas fue la causas principal (las obreras no pueden reemplazarla durante el invierno) ya que no se hallaron indicios de enfermedades de la cría o muerte por falta de alimento.
Al comienzo de la primavera se estimó el nivel de infectación por N. ceranae, la población adulta y el área de cría en las colmenas de los dos apiarios. En ambos se registró un aumento de la nosemosis pasando en el apiario de Salto de 1,4 ± 0,9 a 1,9 ± 1,4 millones de esporas por abeja y en el apiario de San José de 0,9 ± 0,6 a 3,4 ± 1,7 millones de esporas por abeja. En el apiario de Salto se encontró diferencias entre en el nivel de infestación de las colonias sometidas a los diferentes tratamientos (F = 4,19; P = 0,008) estando las colonias que no recibieron fumagilina y con suplementación proteica más infectadas que las colonias tratadas con antibiótico y sin suplementación proteica (P = 0,003). En cambio, en el apiario de San José las colonias de los diferentes grupos no se diferenciaron en el nivel de infección (F = 0,71; P = 0,549) (Figura 2).
En primavera en ninguno de los apiarios se encontraron diferencias estadísticas entre las colonias de los diferentes grupos en la población de abejas (Salto: Chi2 = 2,262; P = 0,52; San José: Chi2 = 1,579; P = 0,66) y el área de cría (Salto: Chi2 = 5,476; P = 0,14; San José: Chi2 = 3,380; P = 0,34) (Figura 3).
Discusión
Las colonias que se retiraron de las forestaciones de E. grandis al terminar la floración, no sufrieron pérdidas relevantes y llegaron a la primavera en buenas condiciones, a pesar de estar fuertemente infectadas por N. ceranae. Este resultado fue independiente de si las colonias fueron tratadas con fumagilina o recibieron suplementación proteica. Incluso, sorprendentemente, la nosemosis aumentó a lo largo del invierno, especialmente en el apiario de San José. Esto demuestra que N. ceranae no afectaría la supervivencia y desarrollo de las colonias durante el invierno si las colonias son retiradas de las forestaciones de E. grandis al culminar a floración. Resultados análogos fueron los obtenidos por Gómez Pajuelo y col. (2008), William y col. (2011) y Traver y col. (2012) quienes en trabajos similares hallaron que N. ceranae por sí sola, sin otros factores adversos como pueden ser un estrés nutricional, la presencia de V. destructor o la intoxicación por agroquímicos, no tendría efecto sobre las pérdida invernales y el desarrollo primaveral. Esta situación es opuesta a la que ocurre en las colonias que permanecen en las forestaciones de E. grandis durante el invierno, donde N. ceranae sería la responsable de las pérdidas de colonias (Invernizzi y col., 2011b; Mendoza y col., 2012).
En el apiario de San José las colonias tratadas con fumagilina presentaron niveles de nosemosis similares a las colonias sin tratamiento, mientras que en el de Salto solo las colonias que no recibieron fumagilina y con suplementación proteica estaban más infectadas que las colonias tratadas con antibiótico y sin suplementación proteica. La aplicación de fumagilina utilizando candi como vehículo ha sido empleada con éxito por Gregorc y Sulimanović (1996) y Gómez Pajuelo y col. (2008), pero su eficacia ha sido puesta en duda por Williams (1973) y Higes y col. (2011). Este estudio no permitió determinar si la fumagilina aplicada con candi es eficiente en el control de N. ceranae. En primer lugar, el tiempo transcurrido desde la aplicación del antibiótico al análisis de las colonias fue de 79 días en el apiario de Salto y de 98 días en el apiario de San José. En este tiempo las colonias pudieron volver a reinfectarse, por ejemplo a partir de la limpieza de excrementos con esporas. Por otro lado, el hecho de que en cada apiario se dejaran juntas colonias curadas y no curadas con fumagilina favorecería que las primeras tuviesen contacto con las abejas infectadas de las segundas, por ejemplo a través de simple deriva de las abejas entre colonias vecinas, dificultando la eliminación de N. ceranae.
En el apiario de Salto las diferencias detectadas en el número de esporas por abeja entre dos grupos de colonias pudieron deberse tanto al efecto de la fumagilina como del aporte de proteína. En relación a la incidencia del consumo de proteína en el nivel de nosemosis Rinderer y Dell Elliott (1977) y recientemente, Porrini y col. (2011), realizando pruebas de laboratorio observaron que las abejas infectadas con Nosema spp. y alimentadas con polen presentaban más esporas que las abejas a las que no se les suministró polen en la dieta. Sin embargo, Invernizzi y col. (2011b) hallaron en una forestación de E. grandis que las colonias que disponían de polen de diverso origen botánico estaban menos infectadas que las que disponían fundamentalmente de polen de los eucaliptos. Es posible que en colonias que disponen de abundante polen la diversidad del origen botánico juegue un rol relevante en la resistencia a la nosemosis. En este sentido Alaux y col., (2010) encontraron que la diversidad botánica del polen afecta la respuesta inmune de las abejas induciendo una mayor actividad de la glucosa oxidasa en comparación con los pólenes monoflorales, aunque fueran ricos en proteína. Sin embargo, no mejoran la expresión de otros componentes de la respuesta humoral y celular implicados en la resistencia a la nosemosis (Antúnez y col., 2009).
Finalmente, la fuerte incidencia de la nosemosis registrada al comienzo de la primavera se ajusta a las descripciones sobre la estacionalidad de la enfermedad. Así, Fries (1997) señala que N. apis se presenta normalmente al final del invierno y principio de primavera, aunque puede aparecer un pico en otoño. En cambio, Martín-Hernández y col. (2007) encuentran que la nosemosis en España, donde se encuentra a N. apis y N. ceranae, fue perdiendo la estacionalidad. De todos modos, otro estudio reciente sobre la incidencia de N. ceranae a lo largo del año indica que se mantiene la estacionalidad que históricamente presentó N. apis (Traver y col., 2012).
En suma, este estudio muestra que N. ceranae no afecta a las colonias con buena población y reservas de alimentos durante la invernada en zonas con recursos nectaríferos y poliníferos limitados, pero suficientes para mantener la cría, y que la suplementación artificial con proteínas puede aumentar la infección sin que se obtenga ningún otro beneficio.
Bibliografía
1. Alaux C, Ducloz F, Crauser D, Le Conte Y. (2010). Diet effects on honeybee immunocompetence. Biol Lett 6:562-565.
2. Antunez K, Martin-Hernandez R, Prieto L, Meana A, Zunino P, Higes M. (2009). Immune suppression in the honey bee (Apis mellifera) following infection by Nosema ceranae (Microsporidia). Environ Microbiol 11: 2284-2290.
3. Aurori CM, Dezmirean DS, Marghitas LA, Moritz RFA. (2011). Nosema apis and N. ceranae in Western honeybee (Apis mellifera) – geographical distribution and current methods of diagnosis. Bulletin UASVM Animal Science and Biotechnologies 68: 63-70.
4. Cantwell G E. (1970). Standard methods of counting nosema spores. Am Bee J 110: 220–223.
5. Chen Y, Evans JD, Smith IB, Pettis J S. (2008). Nosema ceranae is a long-present and wide-spread microsporidian infection of the European honey bee (Apis mellifera) in the
6. Cox-Foster DL, Conlan S, Holmes EC, Palacios G, Evans JD, Moran NA, Quan, P-L, Briese T, Hornig M, Geiser DM, Martinson V, van Engelsdorp D, Kalkstein AL, Drysdale A, Hui J, Zhai J, Cui L, Hutchison SK, Simons JF, Egholm M, Pettis JS, Lipkin WI (2007). A metagenomic survey of microbes in honey bee colony collapse disorder. Science 318: 283-287.
7. Forsgren E,
8. Fries
9. Fries
10. Fries
11. Fries I, Feng F, da Silva A, Slemenda SB,
12. Gómez Pajuelo A, Torres C, Orantes Bermejo FJ. (2008). Colony losses: a double blind trial on the influence of supplementary protein nutrition and preventative treatment with fumagillin agains Nosema ceranae. J Apic Res 47:84-86.
13. Gregorc A, Sulimanović D. (1996). The effect of Fumagillin in honey-sugar patties on suppression of Nosema disease of the honeybee (Apis mellifera) in mating nuclei. Veterinarski Arhiv 66:129–133.
14. Herbert E W J (1992). Honey bee nutrition. En: Graham JE. The hive and the honey bee. Hamilton, Illinois, Ed Dadant & Sons Inc. pp. 197-233.
15. Higes M, Martín R, Meana A. (2006) Nosema ceranae, a new microsporidian parasite in honeybees in Europe. J Invertebr Pathol 92:93-95.
16. Higes M, García-Palencia P, Martín-Hernández R, Meana A. (2007) Experimental infection of Apis mellifera honeybees with Nosema ceranae (Microsporidia). J Invertebr Pathol 94:211-217.
17. Higes M, Martín-Hernández R, Botias C, Bailon EG, Gonzales-Porto A, Barrios L, del Nozal MJ, Palencia PJ, Meana A. (2008) How natural infection by Nosema ceranae causes honeybee colony collapse. Environ Microbiol 10:2659-2669.
18. Higes M, Martín-Hernández R, Meana A. (2010). Nosema ceranae in Europe: An emergent type C nosemosis. Apidologie. 41:375–392.
19. Higes M, Nozal MJ, Alvaro A, Barrios L, Meana A, Martín-Hernández R, Bernal JL. (2011). The stability and effectiveness of fumagillin in controlling Nosema ceranae (Microsporidia) infection in honey bees (Apis mellifera) under laboratory and field conditions. Apidologie. 42: 64–377.
20. Invernizzi C, Abud C, Tomasco I, Harriet J, Mendoza Y, Ramallo G, Campá J, Katz E, Gardiol G, Mendoza Y. (2009). Presencia de Nosema ceranae en abejas melíferas (Apis mellifera) en Uruguay. J Invertebr Pathol 101:150-153.
21. Invernizzi C, Antúnez K, Campa JP, Harriet J, Mendoza Y, Santos E, Zunino P. (2011a). Sanitary situation of the Uruguayan honeybees. Veterinaria 42:9–13.
22. Invernizzi C, Santos E, García E, Daners G, Di Landro R, Saadoun A, Cabrera C. (2011b). Sanitary and nutritional characterization of honeybee colonies in Eucalyptus grandis plantations in
23. Klee J, Besana AM, Genersch E, Gisder S, Nanetti A, Tam DQ, Chinh TX, Puerta F, Ruz JM, Kryger P, Message D, Hatjina F, Korpela S, Fries I, Paxton RJ. (2007). Widespread dispersal of the microsporidian Nosema ceranae, an emergent pathogen of the western honey bee, Apis mellifera. J Invertebr Pathol 96:1-10.
24. Martin-Hernandez R, Meana A, Prieto L, Salvador AM, Garrido-Bailon E, Higes M. (2007). Outcome of colonization of Apis mellifera by Nosema ceranae. Appl Environ Microbiol 73:6331-6338.
25. Mendoza Y, Harriet J, Campa J, Katz H, Ramallo G, Díaz-Cetti S, Invernizzi C. (2012) Control de Nosema ceranae en colonias de abejas (Apis mellifera) en forestaciones de Eucalyptus grandis. Agrociencia. En prensa.
26. Neumann P, Carreck N. (2010). Honey bee colony losses. J Apic Res 49:1-6.
27. Paxton RJ, Klee J, Korpela , Fries I. (2007). Nosema ceranae has infected Apis mellifera in
28. Porrini MP, Sarlo EG, Medici SK, Garrido PM, Porrini DP, Damiani N, Eguaras MJ. (2011). Nosema ceranae development in Apis mellifera: influence of diet and infective inoculum. J Apic Res 50:35–41.
29. Potts S, Roberts S, Dean R, Marris G, Brown M, Jones R, Neumann P, Settele J. (2010). Declines of managed honey bees and beekeepers in
30. R Development Core Team. (2010). R: A language and environment for statistical computing. R Foundation for Statistical Computing.
31. Rinderer TE, Dell Elliott K. (1977). Worker honey bee response to infection with Nosema apis: influence of diet. J Econ Entomol. 70:431–433.
32. Stokstad E. (2007). The case of the empty hives. Science 316:970-972.
33. Traver B E, Williams M R,
34. Van Engelsdorp D, Evans JD, Saegerman C, Mullin C, Haubruge E, Nguyen BK, Frazier M, Frazier J, Cox-Foster D, Chen Y, Underwood R, Tarpy DR, Pettis JS. (2009). Colony collapse disorder: a descriptive study. PLoS One 4: e6481.
35. Williams J L. (1973). Fumagillin-treated extender patties ineffective for Nosema control in nuclei. Am Bee J 113:58–59.
36. Williams G R, Shutler D, Little C M, Burgher-Maclellan KL,
Fuente: http://www.revistasmvu.com.uy
Ricardo Carrera
Blog: Http://apiculturauruguay.blogspot.com/
La abeja centinela del medio ambiente





No hay comentarios:
Publicar un comentario